Попередня сторінка: Алкени й алкіни: гомологічні ряди, ізо�...
Наступна сторінка: Бензен — найпростіший ароматичний ву�...
Пригадайте:
• фізичні властивості етену та етину;
• реакції гідрування та галогенування етену й етину (за § 1);
• знебарвлення бромної води (розчину брому у воді) є якісною реакцією на ненасичені сполуки.
Хімічні властивості етену та етину
У 9 класі ви вже вивчали реакції гідрогенізації (гідрування) та галогенування етену й етину.
Ці реакції ілюструють ненасиче-ний характер цих вуглеводнів, а саме можливість молекул етену й етину приєднувати молекули інших речовин, тобто вступати в реакції приєднання. Але етен та етин здатні приєднувати не тільки молекули водню та галогенів, їхні хімічні властивості значно ширші.
Для алкенів та алкінів характерними є реакції приєднання:
• водню — гідрогенізація;
• галогеноводнів (HF, HCl, HBr, HI) — гідрогенгалогенування;
• води — гідратація.
1. Гідрогенгалогенування. Процес приєднання молекул галогеноводнів (HF, HCl, HBr, HI) називають гідрогенгалогенуванням. Реакція відбувається так само, як і приєднання водню або галогенів: кратний зв’язок між атомами Карбону розривається (перетворюється на одинарний), а за місцем розриву зв’язку приєднуються атоми Гідрогену й галогену.
Для етену:

Етин у цю реакцію вступає в один або два етапи залежно від співвідношення реагентів.
У разі співвідношення 1 : 1 одна молекула етину приєднує одну молекулу галогеноводню, і реакція відбувається в один етап:

Якщо хлороводню у два рази більше за етин, то на другому етапі до утвореного хлороетену приєднується ще одна молекула га-логеноводню:
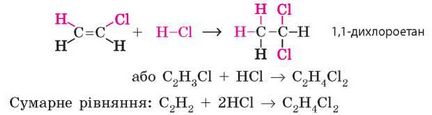
Реакція гідрогенгалогенування відбувається за звичайних умов і лише з хлороводнем — за незначного нагрівання.
Залишок CH2=CH- називають вініл, тому в хлороетену є ще одна назва — вінілхлорид, яку вживають частіше за номенклатурну назву, особливо в промисловості. Вінілхлорид є сировиною (мономером) для промислового добування дуже цінного полімеру — полівінілхлориду (ПВХ).
2. Гідратація. Процес приєднання молекули води називають гідратацією. Якщо попередні властивості етену й етину принципово не відрізнялися, то гідратація цих сполук відбувається по-різному.
Гідратація етену відбувається під час пропускання його крізь розчин кислот (сульфатної чи ортофосфатної). При цьому до одного атома Карбону приєднується атом Гідрогену, а до іншого — група -OH. Продуктом реакції є спирт:

Гідратація етину (реакція Кучерова) відбувається за наявності солей Меркурію(ІІ). Спочатку утворюється нестійкий ненасичений спирт (вініловий спирт, його нестійкість позначено квадратними дужками із зірочкою), який одразу перетворюється на етаналь (оцтовий альдегід):

Цю реакцію відкрив та детально дослідив М. Г. Кучеров, тому її називають його ім’ям. Неможливість існування не-насичених спиртів, у яких група -OH приєднана до карбонового ланцюга поряд із подвійним зв’язком, довів український учений О. П. Ельтеков і сформулював правило, що назване його ім’ям.

3. Часткове окиснення. Під частковим окисненням часто розуміють неповне згоряння. І етен, і етин за умови нестачі кисню згоряють кіптявим полум’ям унаслідок утворення вуглецю:

Часткове окиснення етену відбувається під час пропускання ете-ну крізь розчин калій перманганату з утворенням етиленгліколю (реакція Вагнера):
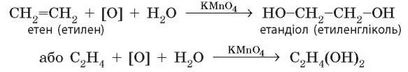
В органічній хімії у схемах реакцій окиснення часто не пишуть хімічну формулу окисника, а замінюють її символом [О]. Тим самим позначають процес додавання атомів Оксигену. В іншому випадку в рівняннях реакцій було б досить складно добирати коефіцієнти.
Під час реакції відбувається знебарвлення розчину калій перманганату, тому цю реакцію разом зі знебарвленням бромної води використовують як якісну для виявлення ненаси-чених сполук.
Промислове значення має часткове окиснення етену киснем за наявності срібла як каталізатора. Продуктом є цінна для промисловості речовина — етиленоксид, що є сировиною для добування етиленгліколю та поліетиленгліколю.


Ключова ідея
Етен та етин виявляють набагато більшу хімічну активність порівняно з ал-
канами: у багато взаємодій вони вступають за звичайних умов. Для нена-
сичених вуглеводнів характерними є реакції приєднання.
Контрольні запитання
140. Які хімічні властивості характерні для ненасичених вуглеводнів?
141. За допомогою яких реакцій можна довести, що етен чи етин — це не-насичені сполуки?
142. Поясніть, чому за однакового об'єму етин приєднує у два рази більше водню за етен.
143. Складіть рівняння реакцій взаємодії етену й етину: а) з воднем; б) гідроген бромідом; в) хлором.
Завдання для засвоєння матеріалу
144. У який спосіб можна відрізнити метан від суміші етану з етеном? Складіть відповідні рівняння реакцій.
145. Історична назва алкенів — олефіни — пішла від того, що етен із хлором утворює олієподібний продукт («масло голландських хіміків», відкрите 1795 року). Складіть рівняння цієї реакції.
146. Складіть рівняння реакцій взаємодії етину кількістю речовини 1 моль із хлором кількістю речовини 2 моль та назвіть продукт реакції.
147. Складіть рівняння реакції для здійснення перетворень за схемою:

Комплексні завдання
148. Яку масу хлоропропану можна добути з пропену об'ємом 11,2 л (н. у.)?
149. Обчисліть об'єм кисню, необхідний для повного згоряння бут-2-ену об'ємом 180 л.
150. Обчисліть об'єм водню, з яким взаємодіє: а) етен масою 7 г; б) етин об'ємом 5,6 л (н. у.).
151. Обчисліть масу продукту реакції взаємодії пропіну об'ємом 11,2 л (н. у.) із надлишком хлору.
152. Обчисліть масу дихлороетану, що можна добути гідрогенгалогенуван-ням етину об'ємом 16,8 л (н. у.).
153. На бромування етену витрачено 100 г розчину з масовою часткою брому 6,4 %. Обчисліть масу продукту реакції.
154. Суміш метану й етену об'ємом 0,56 л (н. у.) пропустили крізь розчин брому масою 160 г з масовою часткою 2 %. Обчисліть об'ємну частку етену в суміші.
155. Для приєднання до алкену масою 8,4 г знадобилося 0,15 моль водню. Визначте формулу алкену.
156. Суміш етену, пропану й пропену об'ємом 1 л під час реакції приєднує хлор масою 3,55 г. Який об'єм водню може приєднати 1 л такої суміші?
Це матеріал з підручника Хімія 10 клас Григорович
Наступна сторінка: Бензен — найпростіший ароматичний ву�...